Насичені спирти – КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина III. ОРГАНІЧНА ХІМІЯ
Розділ 17. КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ
§ 17.1. Насичені спирти
До кисневмісних органічних сполук, які складаються з атомів вуглецю (карбону), водню (гідрогену) і кисню (оксигену), належать спирти, феноли, альдегіди, кетони, карбонові кислоти, прості і складні ефіри (етери і естери), вуглеводи тощо. їх хімічні властивості визначаються наявністю в молекулах різних функціональних груп.
Спирти – це органічні сполуки, у молекулах яких містяться
Їх можна розглядати як похідні вуглеводнів, у молекулах яких один або кілька атомів водню заміщені гідроксильними групами.
Номенклатура та ізомерія спиртів. Назви спиртів виводять з назв радикалів, а також з назв вуглеводнів, додаючи закінчення – ол (міжнародні назви): СН3ОН – метиловий спирт, або метанол; С2Н5ОН – етиловий спирт, або етанол; С2Н5ОН – пропіловий спирт, або пропанол, і т. д. Ці спирти утворюють гомологічний ряд, бо вони за складом молекул відрізняються один від одного на гомологічну різницю.
Починаючи з третього представника гомологічного ряду – пропанолу, у спиртів з’являються ізомери:
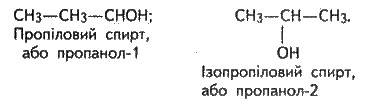
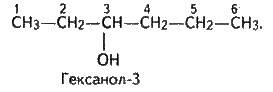
Відповідно до міжнародної номенклатури цифрою після назви спирту позначають, з яким по порядку вуглецевим атомом сполучена гідроксильна група, наприклад:
У спиртів завжди більше ізомерів, ніж у відповідних насичених вуглеводнів. Наприклад, бутан має два ізомери (нормальний бутан та ізобутан, див. § 15.3), бутиловий спирт – чотиpи:
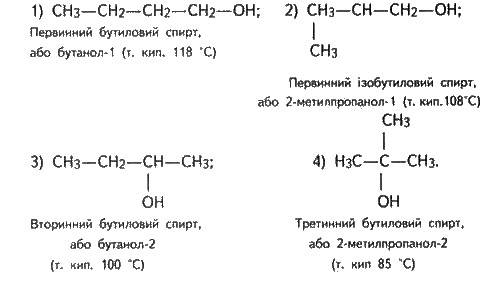
Тут словами “первинний”, “вторинний” і “третинний” визначається місце гідроксильної групи. Як бачимо, число ізомерів у спиртів залежить від будови радикалів і розміщення гідроксильної групи.
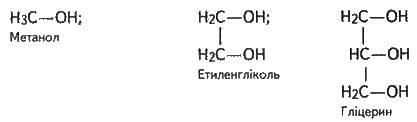
Якщо у молекулі спирту є одна гідроксильна група, то він називається одноатомним, дві – двохатомним, три – трьохатомним і т. д. Найпростішими представниками одноатомних, двохатомних і трьохатомних спиртів відповідно є метанол, етиленгліколь і гліцерин:
Властивості спиртів. Нижчі спирти – рідини; вищі – з числом вуглецевих атомів понад 12 – тверді речовини. Всі спирти легші за воду. Розчинність їх у воді зменшується відповідно до зростання молекулярної маси. Метиловий і етиловий спирти змішуються з водою в будь-яких співвідношеннях.
Молекули спиртів асоційовані внаслідок виникнення між ними водневих зв’язків (див. § З. б):
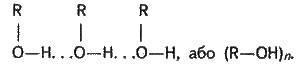
Цим пояснюється те, що уже перші члени гомологічного ряду спиртів – рідини, які мають порівняно високі температури кипіння. Утворенням водневих зв’язків між молекулами спирту і води пояснюється їх легка розчинність у воді. Зменшення ж розчинності у наступних членів гомологічного ряду спричинено зростанням числа атомів вуглецю у вуглеводневому радикалі. Водневі зв’язки – неміцні (17-22 кДж/моль) і при випаровуванні спиртів легко розриваються.
Хімічні властивості спиртів зумовлені наявністю в їх молекулах полярних ковалентних зв’язків С-O і О-Н. Спирти вступають у хімічні реакції з розривом одного із цих зв’язків. Оскільки обидва зв’язки полярні, то їх розрив відбувається за іонним (гетеролітичним) механізмом з утворенням органічних аніонів або катіонів:
R-O-Н ⇆ R-О – + Н+ або R – О-Н ⇆ R+ + OН-.
Дисоціація спиртів на іони відбувається незначною мірою, тому спирти дають нейтральну реакцію – за їх наявності не змінюється забарвлення лакмусу чи фенолфталеїну.
Як можна побачити з електронної формули, наприклад, етилового спирту
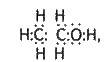
Електронна пара, яка зв’язує атом кисню з атомом водню, зміщена до атома кисню як до більш електронегативного атома. Цей атом водню відрізняється від інших атомів водню у молекулі спирту, у нього зв’язок слабший порівняно із зв’язком між вуглецевими і водневими атомами. Тому водень гідроксильної групи може легко заміщуватись на метал.
Дійсно, спирти енергійно взаємодіють з металічним натрієм або калієм, виділяючи водень і утворюючи так звані алкоголяти :
2С2Н5ОН + 2Na⇆ 2C2H5ONa + Н2.
Етилат натрію
Алкоголяти – речовини нестійкі і водою розкладаються на спирт і луг:
C2H5ONa + Н2О ⇆ С2Н5ОН +NaOH.
З лугами одноатомні спирти взаємодіють оборотно:
С2Н5ОН + NaOH ⇆ C2H5ONa + Н2O.
При цьому рівновага сильно зміщена в бік спирту й лугу.
Проте за певних умов (наприклад, коли видаляти воду) її можна змістити в бік алкоголяту. На цьому грунтується промислове добування етилату натрію.
Спирти порівняно легко окиснюються такими окисниками, як КМnО4, К2Сr2O7, киснем повітря за наявності каталізаторів (платини, міді). При цьому виявляється вплив гідроксильної групи, а саме: кисень приєднується до атома вуглецю, який зв’язаний з групою ОН:
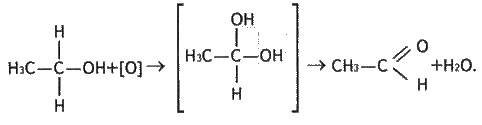
Проміжним продуктом є спирт з двома гідроксильними групами біля одного атома вуглецю. Такі спирти нестійкі і розкладаються на альдегід і воду.
Спирти, як і більшість інших органічних сполук, горять. Наприклад:
2СН3ОН + 3O2 ⇆ 2СO2 + 4Н2O.
Горіння можна уявити як граничне окиснення. Тоді окиснення метилового спирту можна виразити схемою:
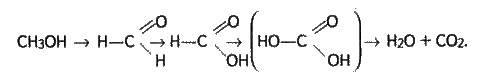
Спирти взаємодіють з галогеноводнями:
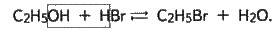
У цій реакції функціональна група заміщується бромом. Реакція оборотна: за наявності лугу вона зміщується в бік вихідних речовин, у надлишку кислоти – в бік кінцевих речовин.
Важлива властивість спиртів – їх здатність до дегідратації (втрата води). Дегідратація відбувається при нагріванні спирту (140°С) з водовідбираючими речовинами, наприклад з концентрованою сірчаною кислотою:
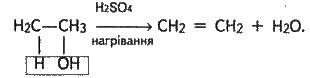
У цьому випадку молекула води відщепилася від однієї молекули спирту. За інших умов (при надлишку спирту і нижчій температурі) молекула води відщеплюється від двох молекул спирту, внаслідок чого утворюється етер:

Етери (прості ефіри) – це органічні речовини, молекули яких складаються з вуглеводневих радикалів, сполучених через атом кисню: R’-O-R”, де R’, R” – радикали, які можуть бути різними або однаковими.
Діетиловий, або сірчаний, ефір1 – добрий розчинник багатьох органічних речовин, застосовується для чищення тканин, в медицині – при хірургічних операціях, оскільки має анестезуючі властивості.
З окремих представників одноатомних спиртів розглянемо метанол і етанол; двохатомних – етиленгліколь; трьохатомних – гліцерин.
1 Назва “сірчаний” збереглася від найпершого способу добування діетилового ефіру взаємодією спирту із сірчаною кислотою.
