Складні ефіри (естери). Реакції етерифікації та омилення – КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина III. ОРГАНІЧНА ХІМІЯ
Розділ 17. КИСНЕВМІСНІ ОРГАНІЧНІ СПОЛУКИ
§ 17.13. Складні ефіри (естери). Реакції етерифікації та омилення
Добування складних ефірів. При взаємодії карбонових кислот зі спиртами утворюються складні ефіри. Наприклад, з оцтової кислоти й етилового спирту за наявності каталізатора(концентрованої сірчаної або соляної кислоти) добувають складний ефір – етилацетат:
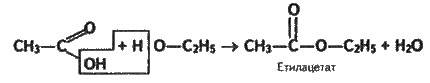
Загальна формула складних ефірів 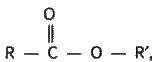
Реакція утворення складного ефіру з кислоти і спирту називається реакцією етерифікації (“етер” – ефір).
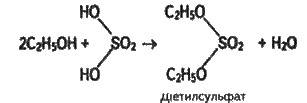
Реакції етерифікації характерні не тільки для карбонових, а й для мінеральних кислот. Наприклад, при взаємодії етилового спирту із сірчаною кислотою утворюється складний ефір – діетилсульфат:
З азотної кислоти і спирту утворюється етилнітрат:
Номенклатура. Назви складних ефірів найчастіше утворюються від назв кислот і спиртів, залишки яких входять до їх складу, з додаванням слова “ефір” або ж за типом назв солей. Наприклад:
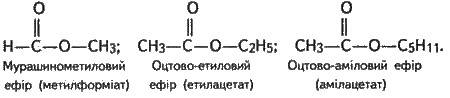
Властивості. Складні ефіри карбонових кислот – рідини, малорозчинні у воді, але добре розчиняються у спирті. Особлива будова молекул складних ефірів (у них немає, наприклад, гідроксильних груп) зумовлює відсутність водневих зв’язків, а отже, і відсутність асоційованих молекул, характерних для спиртів і кислот. Тому складні ефіри киплять при нижчих температурах, ніж відповідні їм кислоти.
Багато складних ефірів мають приємний фруктовий запах. Так, мурашино-аміловий ефір має запах вишень, мурашино-етиловий – рому, оцтово-аміловий – бананів, масляно-етиловий – абрикосів, масляно-бутиловий – ананасів, ізовалеріано-етиловий – яблук.
Складний ефір, взаємодіючи з водою, знову перетворюється на кислоту і спирт. Наприклад:
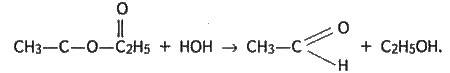
Реакція взаємодії складного ефіру з водою, внаслідок якої утворюються спирт і кислота, називається омиленням, або гідролізом. Вона зворотна щодо реакції етерифікації.
Очевидно, процес етерифікації оборотний:
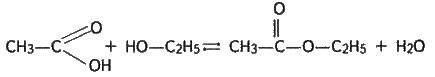
І при встановленні хімічної рівноваги в реагуючій суміші будуть міститись як вихідні, так і кінцеві речовини.
Каталізатор – іони водню (мінеральні кислоти) – однаково прискорює пряму і зворотну реакції (етерифікації і гідролізу), тобто прискорює досягнення рівноваги. Щоб змістити її в бік утворення ефіру, вихідну кислоту або спирт слід брати у надлишку. Того самого результату буде досягнуто, якщо вилучати один з продуктів реакції зі сфери взаємодії: відганяти ефір або зв’язувати воду водовідбираючими речовинами. Іони ОН посилюють гідроліз складних ефірів: рівновага зміщується в бік кислоти і спирту й реакція стає практично необоротною, тому що карбонова кислота, яка утворюється, з лугом дає сіль:
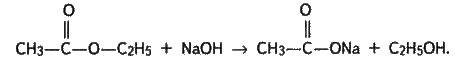
Взаємодія складних ефірів з водою – їх найважливіша хімічна властивість (прості ефіри (етери) гідролізу не піддаються).
Застосування. Багато складних ефірів застосовуються як добрі розчинники органічних речовин, їх широко використовують для виготовлення фруктових есенцій. Деякі складні ефіри застосовують у медицині: ізоамілнітрит послаблює приступи при стенокардії, етилнітрит розширює периферійні кровоносні судини.