Загальна характеристика підгрупи оксигену – ПІДГРУПА ОКСИГЕНУ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 9. ПІДГРУПА ОКСИГЕНУ
§ 9.1. Загальна характеристика підгрупи оксигену
До підгрупи оксигену входять п’ять елементів: оксиген, сульфур, селен, телур і полоній (полоній – радіоактивний елемент). Це р-елементи VI групи періодичної системи Д. І. Менделєєва. Вони мають групову назву – халькогени, що означає “ті, що утворюють руди”.
Таблиця 9.1. Властивості елементів підгрупи оксигену
Властивість | O | S | Se | Те | Ро |
1. Порядковий номер | 8 | 16 | 34 | 52 | 84 |
2. Валентні електрони | 2s22p4 | 3s23p4 | 4s24p4 | 5s25p4 | 6s26p4 |
3. Енергія іонізації атома, еВ | 13,62 | 10,36 | 9,75 | 9,01 | 8,43 |
4. Відносна електронегативність | 3,50 | 2,60 | 2,48 | 2,01 | 1,76 |
5. Ступінь окиснення у сполуках | -1,-2, +2 | -2, +2 +4,+6 | -2, | -2, +4,+6 | -2,+4 |
6. Радіус атома, нм | 0,066 | 0,104 | 0,117 | 0,137 | 0,164 |
В атомів халькогенів однакова будова зовнішнього енергетичного рівня – ns2npA (табл. 9.1, п. 2). Цим пояснюється подібність їх хімічних властивостей. Усі халькогени у сполуках з гідрогеном і металами виявляють ступінь окиснення -2, а у сполуках з оксигеном та іншими активними неметалами – звичайно +4 і +6 (див. табл. 9.1, п. 5). Для оксигену, як і для флуору, не типовий ступінь окиснення, що дорівнює номеру групи. Він виявляє ступінь окиснення звичайно -2, а в сполуці з флуором +2. Такі значення ступенів окиснення випливають з електронної будови халькогенів:
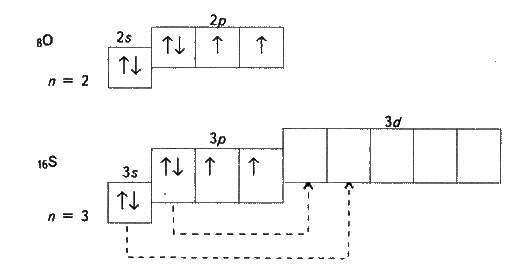
В атома оксигену на 2р-підрівні є два неспарених електрони. Його електрони не можуть розпаровуватись, оскільки немає d-підрівня на зовнішньому (другому) рівні, тобто немає вільних орбіталей. Тому валентність оксигену завжди дорівнює двом, а ступінь окиснення -2 і +2 (наприклад, в Н2О і OF2). Такі самі валентність і ступені окиснення в атома сульфуру в незбудженому стані. При переході у збуджений стан (що має місце при підведенні енергії, наприклад при нагріванні) в атома сульфуру спочатку роз’єднуються Зр-, а потім 3s-електрони (показано стрілками). Число неспарених електронів, а отже, і валентність у першому випадку дорівнюють чотирьом (наприклад, в SO2), а в другому – шести (наприклад, в SO3). Очевидно, парні валентності 2, 4, 6 властиві аналогам сульфуру – селену, телуру і полонію, а їх ступені окиснення можуть дорівнювати -2, +2, +4 і +6.
Водневі сполуки елементів підгрупи оксигену відповідають формулі H2R (R – символ елемента): Н2О, H2S, Н2Sе, Н2Те. Вони називаються хальководнями. При розчиненні їх у воді утворюються кислоти (формули такі самі). Сила цих кислот зростає зі збільшенням порядкового номера елемента, що пояснюється зменшенням енергії зв’язку в ряду сполук H2R. Вода, що дисоціює на іони Н і ОН-, є амфотерним електролітом.
Сульфур, селен і телур утворюють однакові форми сполук з оксигеном типу RO2 і RO3. їм відповідають кислоти типу H2RO3 і H2RO4. Зі збільшенням порядкового номера елемента сила цих кислот зменшується. Всі вони виявляють окисні властивості, а кислоти типу H2RO3 – також і відновні.
Закономірно змінюються властивості простих речовин: зі збільшенням заряду ядра послаблюються неметалічні і посилюються металічні властивості. Так, оксиген і телур – неметали, але останній має металічний блиск і проводить електричний струм.