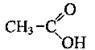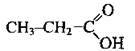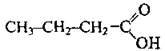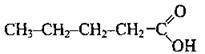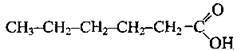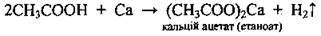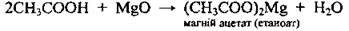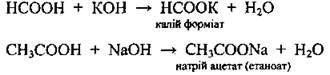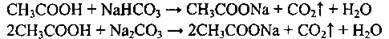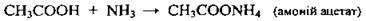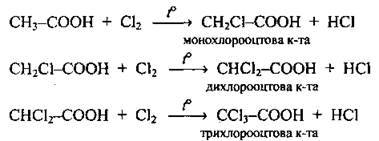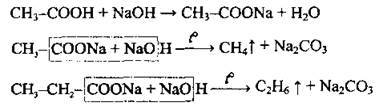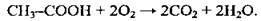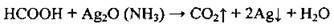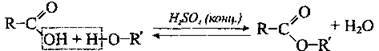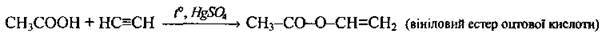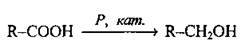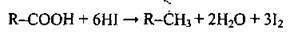Насичені монокарбонові кислоти – Карбонові кислоти – Оксигеновмісні органічні сполуки
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ
12. Оксигеновмісні органічні сполуки
12.4. Карбонові кислоти
Карбонові кислоти – це похідні вуглеводнів, до складу молекул яких входять одна або декілька карбоксильних груп – СООН.
Класифікація карбонових кислот
Розрізняють:
1) залежно від кількості карбоксильних груп (основності):
– монокарбонові (однооснбвні):
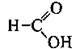
НСООН мурашина (метанова) кислота
СН3СООН оцтова (ацетатна, етанова) кислота
– дикарбонові
НООС-COОH щавлева кислота
НООС-СН2-СООН малонова кислота
– трикарбонові (трьохосновні):
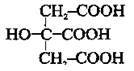 лимонна кислота
лимонна кислота
2) залежно від природи вуглеводневого замісника, сполученого з карбоксильною групою:
– насичені:
СН3-СН2-СООН пропанова кислота
– ненасичені:
СН2=СН-СООН акрилова кислота
– аліциклічні:
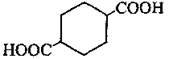 циклогексан-1,4- дикарбонова кислота
циклогексан-1,4- дикарбонова кислота
– ароматичні:
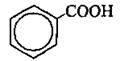 бензойна кислота
бензойна кислота
3) залежно від кількості атомів Карбону в алкільному заміснику:
– нижчі (низькомолекулярні):
Н-СООН
СН3-СООН етанова кислота
С2Н5-СООН пропанова кислота
С3Н7-СООН бутанова кислота
– вищі (високомолекулярні):
С15Н31-СООН пальмітинова кислота
С17Н29-СООН ліноленова кислота
С17Н31-СООН лінолева кислота
С17Н33-СООН олеїнова кислота
С17Н35-СООН стеаринова кислота
12.4.1. Насичені монокарбонові кислоти
Карбоксильну групу 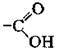 можна розглядати як поєднання карбонільної
можна розглядати як поєднання карбонільної 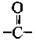 і гідроксильної – ОН груп. Електронна густина у карбонільній групі зміщена до Оксигену, внаслідок чого він набуває часткового негативного заряду δ-, а атом Гідрогену гідроксильної групи отримує ще більший (порівняно зі спиртами) частковий позитивний заряд δ+ і більшу рухомість. Завдяки чому водневі зв’язки між молекулами карбонових кислот виявляються сильнішими і в розчинах вони існують переважно у вигляді димерів. З другого боку, електронна густина з а-атома Карбону алкільного замісника зміщується до карбоксильного атома Карбону. Унаслідок цього атоми Гідрогену біля а-атома Карбону також набувають більшої рухливості, що дає їм змогу заміщуватись на атоми галогенів.
і гідроксильної – ОН груп. Електронна густина у карбонільній групі зміщена до Оксигену, внаслідок чого він набуває часткового негативного заряду δ-, а атом Гідрогену гідроксильної групи отримує ще більший (порівняно зі спиртами) частковий позитивний заряд δ+ і більшу рухомість. Завдяки чому водневі зв’язки між молекулами карбонових кислот виявляються сильнішими і в розчинах вони існують переважно у вигляді димерів. З другого боку, електронна густина з а-атома Карбону алкільного замісника зміщується до карбоксильного атома Карбону. Унаслідок цього атоми Гідрогену біля а-атома Карбону також набувають більшої рухливості, що дає їм змогу заміщуватись на атоми галогенів.
Фізичні властивості насичених монокарбонових кислот
Перші три члени гомологічного ряду насичених монокарбонових кислот – мурашина, оцтова, пропіонова – рухливі рідини з різким запахом, змішуються з водою у будь-яких пропорціях. Члени від 4-го до 9-го – оліїсті рідини з різким неприємним запахом1, погано розчинні у воді. Наступні члени гомологічного ряду – тверді речовини без запаху, нерозчинні у воді, але добре розчиняються в органічних розчинниках (етері, бензені).
Кислоти мають вищі, порівняно з відповідними спиртами, температури кипіння. Це зумовлено міцними водневими зв’язками між парами молекул кислоти й утворенням стабільних асоціатів, димерів, які розпадаються лише за високої температури. Наприклад, понад 250 °С – для ацетатної кислоти.
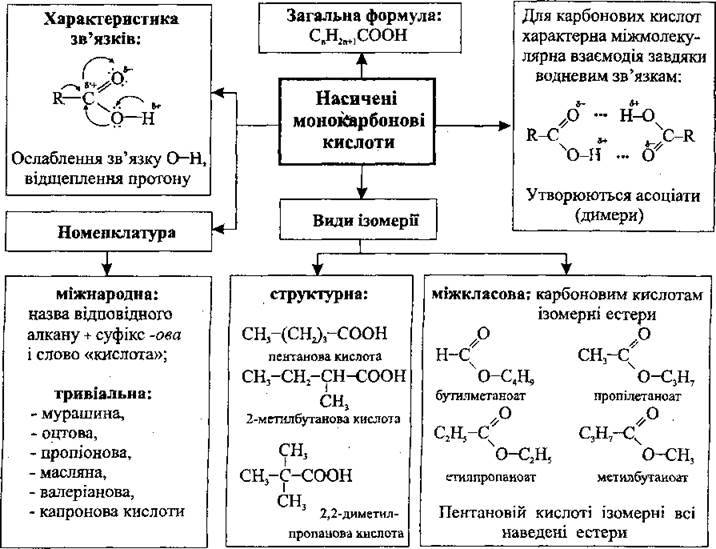
Гомологічний ряд насичених монокарбонових кислот
Одноосновні карбонові кислоти (монокарбонові кислоти) – похідні алканів, у молекулах яких один атом Гідрогену заміщений на карбоксильну групу. Насичені монокарбонові кислоти утворюють гомологічний ряд, загальна формула якого СnН2n+1СООН або R-COOH, де R – алкільний замісник (або атом Гідрогену – у мурашиній кислоті).
Молекулярна формула кислоти | Скорочена структурна формула кислоти | Назва кислоти | |
Міжнародна | Тривіальна (традиційна) | ||
HCOOH |
| Метанова кислота | Мурашина (форміатна) кислота |
СН3СООН |
| Етанова кислота | Оцтова (ацетатна) кислота |
С2Н5СООН |
| Пропанова кислота | Пропіонова кислота |
С3Н7СООН |
| Бутанова кислота | Масляна кислота |
С4Н9СООН |
| Пентанова кислота | Валеріанова кислота |
С5Н11СООН |
| Гексанові кислота | Капронова кислота |
Хімічні властивості насичених монокарбонових кислот
Завдяки більшій рухомості гідроксильного атома Гідрогену карбонові кислоти можуть дисоціювати:
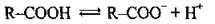
Сила карбонових кислот, як і розчинність у воді, у гомологічному ряду зменшується зі збільшенням молекулярної маси. Оцтова кислота сильніша за карбонатну, але слабша за інші мінеральні кислоти.
Солеутворення | З активними металами |
| |
З основними оксидами |
| ||
З основами |
| ||
З карбонатами |
| ||
З аміаком |
| ||
Заміщення α-гідрогенових атомів в алкільному заміснику |
| Монохлорооцтова кислота сильніша за оцтову у 80 разів, а трихлорооцтова – у 15 000 разів | |
Руйнування карбоксильної групи (декарбоксилювання) |
| ||
Окиснення |
Мурашина кислота окислюється аміачним розчином
| ||
Реакції за участі групи -ОН | Зі спиртами (реакція естерифікації) |
| Відбувається за наявності мінеральних кислот |
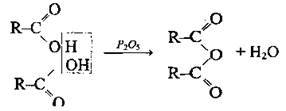
Відщеплення молекули води від двох молекул кислоти (реакція дегідратації) |
Утворюються ангідриди кислот, які при нагріванні з водою дають відповідні кислоти | Реакція відбувається за наявності водовідбірних речовин: Аl2O3 – для твердої фази і H2SO4 (конц.), Р2O5- для рідкої. | |
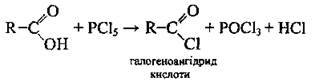
Заміщення групи – ОН на атом галогену |
| Відбувається під дією галогенувальних агентів (РСl3, РСl5, SO2Cl2, СOСl2) | |
Приєднання С2Н2 |
| ||
Відновлення |
| Тиск -107 Па, каталізатори – LiAlH4 і В2Н6 | |
| Йодоводень відновлює карбонові кислоти до алканів |
Добування карбонових кислот
1. Окиснення насичених вуглеводнів повітрям або киснем за наявності каталізаторів, тиску і високої температури:
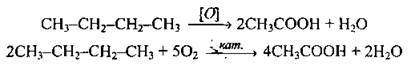
2. Окиснення первинних спиртів, альдегідів:
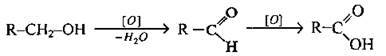
3. Гідроліз гемінальних тригалогенопохідних насичених вуглеводнів:
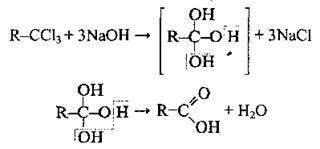
4. Добування метанової кислоти:
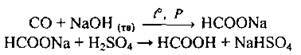
Застосування одноосновних карбонових кислот
Метанову кислоту використовують:
– як відновник в органічному синтезі;
– як розчинник;
– як протраву при фарбуванні тканин і паперу (алюміній форміат), дублення шкіри;
– як консервант зелених кормів для худоби, у харчовій промисловості (харчова добавка Е 236);
– у медицині (“мурашиний спирт” – розчин мурашиної кислоти в етанолі з масовою часткою кислоти 1,25%);
– для дезінфекції бродильних чанів у виробництві спирту, пива.
Етанову кислоту використовують для виробництва:
– ацетатного шовку, незаймистої кіноплівки, органічного скла;
– барвників для тканин;
– медичних препаратів (аспірину);
– естерів (грушевої, яблучної есенції);
– засобів захисту і стимуляторів росту рослин;
– розчинників для лаків,
А також як консервант (Е 260) і приправу в харчовій промисловості та побуті (оцет столовий 3-15 %).
Солі ацетатної кислоти використовують для боротьби зі шкідниками рослин (Cu (II)), у виробництві свинцевих білил (основна сіль Pb (II)) та процесі фарбування тканин (Fe (III), Al).
___________________________________________________________________
1 Такий специфічний запах (і гіркий смак) виникає при маслянокислому бродінні вершкового масла і утворенні масляної кислоти, від чого вона й дістала свою назву.