Тести – Урок 2
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
2. Будова атома
Тести
2.1 Укажіть рядок, що містить назви лише s-елементів
А Натрій, Неон, Хлор
Б Бром, Хлор, Гелій
В Гідроген, Кальцій, Алюміній
Г Гелій, Гідроген, Магній

2.2 Укажіть протонне число елемента, електронна формула якого…3s23p6
А 17
Б 16
В 18
Г 26

2.3 Укажіть кількість нейтронів у ядрі нукліда 31Р
А 46
Б 15
В 16
Г 14
2.4 Укажіть елемент, нуклонне число якого дорівнює 80
А Ванадій
Б Хром
В Манган
Г Бром

2.5 Укажіть символи елементів, які входять до побічної підгрупи V групи періодичної системи
A Br, I, F
Б V, Nb, Та
В Sc, Cd, Hg
Г І, Сl, Мn

2.6 Укажіть елемент, який утворює оксид з вищою валентністю VII
А Бор
Б Манган
В Арсен
Г Сульфур

2.7 Укажіть елемент, що міститься в головній підгрупі IV групи 4 періоду
А Титан
Б Силіцій
В Германій
Г Станум
2.8 Укажіть р-елемент 5 періоду
А Телур
Б Аргентум
В Германій
Г Манган

2.9 Укажіть кількість d-електронів в атомі Купруму
А 9
Б 10
В 8
Г 7

2.10 Укажіть кількість s-електронів в атомі Хрому
А 6
Б 8
В 7
Г 9

2.11 Укажіть валентність Сульфуру в першому збудженому стані
А II
Б V
В IV
Г III

2.12 Укажіть електронну формулу зовнішнього електронного шару атома Сульфуру в другому збудженому стані
A…3s23p33d1
Б…3s13p33d2
В…3s13p43d1
Г…3s23p4

2.13 Укажіть s-елементи: 1) В; 2) Не; 3) Сl; 4) Ва; 5) Вr; 6) Cs
А 2, 3, 4
Б 2, 5, 6
В 2, 4 ,6
Г 1, 3, 4

2.14 Укажіть p-елементи: 1) Be; 2) Н; 3) Сl; 4) В; 5) Ва; 6) Ge
А 1, 3, 4
Б 2, 5, 6
В 2, 4, 6
Г 3, 4, 6

2.15 Укажіть d-елементи: 1) Мn; 2) Sr; 3) Сr; 4) Ва; 5) Fe; 6) Аr
А 1, 3, 4
Б 1, 3, 5
В 2, 3, 6
Г 1, 3, 6
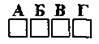
2.16 Укажіть кількість p-електронів в атомі Феруму
А 10
Б 6
В 11
Г 12

2.17 Укажіть d-елемент 4-го періоду
А Хе
Б Zn
В Se
Г Са

2.18 Валентність Хлору в третьому збудженому стані
А III
Б І
В II
Г VII

2.19 Укажіть кількість електронів, що розміщуються на d-підрівні в атомі Цинку
А 8
Б 14
В 10
Г 12

2.20 Укажіть кількість d-електронів у йоні Fe3+
А 2
Б 7
В 5
Г 4

2.21 Розташуйте елементи за зменшенням кількості енергетичних рівнів в електронній оболонці їхніх атомів
А Карбон
Б Гелій
В Калій
Г Стронцій
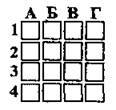
2.22 Розташуйте елементи за збільшенням їхніх протонних чисел
А Берилій
Б Бром
В Бор
Г Флуор
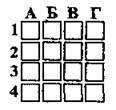
2.23 В атомі p-елемента в зовнішньому електронному шарі розміщується три електрони. Молярна маса його оксиду – 102 г/моль. Укажіть кількість електронів у йоні цього елемента
А 3
Б 5
В 10
Г 6

2.24 Укажіть електронну родину елементів, до якої належать Купрум і Хром
А s-елементи
Б p-елементи
В d-елементи
Г f-елементи

2.25 Укажіть, чим кількісно різняться атоми нуклідів Хлору 35Сl і 37Сl
А зарядом ядра
Б кількістю нейтронів
В кількістю протонів
Г кількістю електронів

2.26 Укажіть елемент, атом якого найлегше віддає електрони
A Sr
Б С
В S
Г Be

2.27 Укажіть пару йонів з однаковою електронною конфігурацією зовнішнього електронного шару
А Са2+ і Na+
Б S2- і К+
В Na+ і I-
Г Сl – і Li+

2.28 Укажіть електронну конфігурацію зовнішнього електронного шару елемента, вищий оксид якого відповідає формулі Е2O5
A…3s23p4
Б…4s24p3
В…2s22р2
Г…4s23р5

2.29 Укажіть лужні елементи: 1) Са; 2) К; 3) Na; 4) Cs; 5) Cu; 6) Ag
A 1, 2, 3
Б 2, 3, 5
В 2, 3, 4
Г 2, 3, 6

2.30 Укажіть елементи, менш електронегативні за Сульфур: 1) Флуор; 2) Селен; 3) Оксиген; 4) Силіцій; 5) Берилій; 6) Нітроген
А 2, 4, 5
Б 2, 3, 5
В 2, 3, 4
Г 2, 3, 6

2.31 Укажіть рядок елементів, які входять до малих періодів періодичної системи
А Магній, Калій, Нітроген, Оксиген
Б Купрум, Хлор, Молібден, Нітроген
В Гелій, Фосфор, Бор, Флуор
Г Літій, Гідроген, Кадмій, Йод

2.32 Укажіть елементи, які відносять до s-елементів великих періодів: 1) Ва; 2) Na; 3) Са; 4) Cs; 5) Li; 6) Cu
А 1, 3, 4
Б 2, 4, 6
В 1, 5, 6
Г 1, 4, 6

2.33 Укажіть галогени: 1) Сl; 2) Мn; 3) F; 4) Ва; 5) Тс; 6) Вr
А 1, 2, 3
Б 1, 3, 6
В 2, 3, 4
Г 2, 3, 6

2.34 Укажіть рядок, який включає елементи лише великих періодів
A As, I, К, Cs
Б Аl, S, Na, F
В Si, Sc Ва, Ag
Г Mg, I, Na, Br

2.35 Укажіть рядок, який включає елементи лише побічних підгруп великих періодів
A Cu, Zn, Ge, Аr
Б Be, В, S, Сl
В Не, Ne, Аr, Хе
Г Zn, Fe, Ti, Mo
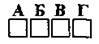
2.36 Установіть послідовність послаблення відновних властивостей елементів з такими електронними конфігураціями зовнішнього електронного шару
A 4s1
Б 5s1
В 4s2
Г 3s2
2.37 Укажіть елемент, атом якого має в зовнішньому електронному шарі 6 електронів
А Сl
Б S
В Si
Г Аl

2.38 Укажіть елементи, які відносять до p-елементів великих періодів: 1) Стронцій; 2) Германій; 3) Молібден; 4) Хром; 5) Селен; 6) Бром
А 2, 3, 5
Б 2, 3, 4
В 1, 5, 6
Г 2, 5, 6

2.39 Укажіть протонне число елемента V групи періодичної системи, що утворює оксигеновмісну кислоту з молярною масою 142 г/моль
А 51
Б 33
В 15
Г 41

2.40 Укажіть елемент, зовнішній електронний шар якого незавершений
А Аr
Б Вr
В Ne
Г Не

2.41 Укажіть кількість нейтронів у ядрі атома нукліда Хлору з нуклонним числом 37
А 26
Б 20
В 30
Г 35

2.42 Укажіть сумарну кількість протонів і електронів у йорі, утвореному атомом Натрію
А 24
Б 21
В 22
Г 19

2.43 Нукліди Купруму з нуклонними числами 63 і 65
А мають різну кількість електронів
Б мають однакову кількість нейтронів
В мають різну кількість протонів
Г мають однакову кількість електронів

2.44 Проаналізуйте твердження щодо нуклідів Аргентум-107 та Аргентум-109 та вкажіть правильне
А нуклід 109Ag має на 2 електрони більше, ніж нукдід 107Ag
Б нуклід 109Ag має на 2 протони більше, ніж нуклід 107Ag
В нуклід 109Ag має на 2 нейтрони більше, ніж нуклід 107Ag
Г нуклід 107Ag має на 2 електрон менше, ніж нуклід 109Ag

2.45 Проаналізуйте твердження щодо нуклідів складу йонів К+ і Са2+ та вкажіть правильне
А в обох йонах різна кількість електронів
Б йони різняться кількістю електронів у зовнішньому електронному шарі
В йони різняться загальною кількістю електронів
Г йони мають однакову кількість електронів у зовнішньому електронному шарі

2.46 Укажіть правильне твердження стосовно йонів Вr – і I-
А мають однакову кількість нейтронів
Б мають однакову кількість протонів
В мають однакову кількість електронів у зовнішньому електронному шарі
Г мають однакову кількість електронів і нейтронів

2.47 Укажіть твердження, правильне для нуклідів 54Сr і 54Fe
А мають однакову кількість електронів
Б мають однакове протонне число
В мають однакове нуклонне число
Г мають однакову кількість і електронів, і протонів

2.48 Укажіть протонне число елемента, що утворює аніон А2- з електронною структурою 1s22s22p6
А 8
Б 6
В 18
Г 9

2.49 Укажіть протонне число елемента, йон якого має 10 електронів і заряд +3
А 12
Б 13
В 14
Г 15

2.50 Установіть відповідність між символом елемента і його електронною формулою зовнішнього електронного шару
Символ: | Електронна формула: |
1 Cs | A…3d54s1 |
2 Сr | Б…4s24p6 |
3 Si | В…6s1 |
4 Кr | Г…3s23p5 |
Д…3s23p2 |
2.51 Установіть відповідність між назвою елемента та родиною, до якої його відносять
Назва: | Родина: |
1 Самарій | А p-елемент |
2 Арсен | Б s-елемент |
3 Ферум | В f-елемент |
4 Барій | Г d-елемент |
Д q-елемент |
2.52 Установіть послідовність зменшення кількості електронів у зовнішньому енергетичному рівні в атомах таких елементів
А Ксенон
Б Магній
В Рубідій
Г Сульфур

2.53 Укажіть протонне число елемента, атом якого має на 4 електрони менше, ніж йон Са2+
А 9
Б 10
В 14
Г 24

2.54 Укажіть символ елемента, атом якого має однакову з йоном Вr – будову зовнішнього електронного шару
А Аr
Б Кr
В Сl
Г S

2.55 Укажіть кількість р-електронів в атомі елемента, який має на 2 електрони більше, ніж йон S2-
А 17
Б 5
В 8
Г 12

2.56 Що спільного в будові атомів Магнію і Хлору?
А кількість електронів у зовнішньому електронному шарі
Б кількість енергетичних рівнів
В кількість нейтронів
Г однаковий заряд ядра

2.57 Укажіть елемент 4 періоду, що виявляє най сильніші неметалічні властивості
А Криптон
Б Нікол
В Селен
Г Бром

2.58 Укажіть елемент, який утворює оксид з вищою валентністю VI
А Натрій
Б Силіцій
В Селен
Г Йод

2.59 Укажіть, як змінюються відновні властивості йонів у ряду F – – Сl – – Вr – – I-
А посилюються
Б спочатку послаблюються, а потім посилюються
В послаблюються
Г спочатку посилюються, а потім послаблюються

2.60 Укажіть елементи, які входять до побічної підгрупи VII групи періодичної системи
А Вr, Мn, Те
Б Mn, Тс, Re
В Вr, Cl, F
Г F, At, Re

2.61 Укажіть елемент 3 періоду, який виявляє найсильніші неметалічні властивості
A Li
Б Ne
В F
Г Сl

2.62 Укажіть елемент, розташований у 5 періоді в головній підгрупі V групи
А Стибій
Б Германій
В Ніобій
Г Тантал

2.63 Укажіть групу, у якій хімічні елементи розташовані в послідовності зменшення електронегативності
A F, N, С, Ge
Б С, Ge, Sn, Si
В Al, Si, P, S
Г Si, Al, Mg, O

2.64 Укажіть елемент 4 періоду, який найсильніше виявляє металічні властивості
А Купрум
Б Калій
В Криптон
Г Кальцій

2.65 Укажіть, як змінюються неметалічні властивості елементів у ряду: Р – Si – Al – Na
А спочатку послаблюються, а потім посилюються
Б посилюються
В послаблюються
Г спочатку посилюються, а потім послаблюються

2.66 У межах періоду зі зменшенням порядкового номера елемента відбувається
А збільшення атомного радіуса та зменшення електронегативності
Б зменшення атомного радіуса та зменшення електронегативності
В збільшення атомного радіуса та збільшення електронегативності
Г зменшення атомного радіуса та збільшення електронегативності

2.67 Укажіть елемент, розташований у 3 періоді, який утворює оксид ЕО2
А Карбон
Б Силіцій
В Бор
Г Літій

2.68 Укажіть групу, в якій розміщений елемент, що утворює летку сполуку з Гідрогеном типу Н2Е
А III
Б IV
В V
Г VI

2.69 Укажіть, яка з поданих нижче характеристик атомів елементів періодично змінюється
А заряд ядра атома
Б кількість енергетичних рівнів в атомі
В кількість електронів у зовнішньому енергетичному рівні
Г кількість протонів

2.70 Кількість енергетичних рівнів визначає належність елемента до
А головної підгрупи
Б певної підгрупи
В побічної підгрупи
Г відповідного періоду

2.71 Укажіть ряд, у якому хімічні елементи розміщено в послідовності зменшення електронегативності
A Cl, Р, Si, Al
Б Са, В, Be, Li
В Be, С, N, F
Г С, N, F, Ne

2.72 Укажіть ряд, у якому хімічні елементи розміщено в послідовності зменшення металічних властивостей
A Cs, Rb, К
Б Са, Zn, Be
В Cs, Li, Al
Г Mg, Ca, Sr

2.73 Ступінь окиснення -4 у сполуках можуть виявляти елементи
А побічної підгрупи ІІ| групи
Б головної підгрупи III групи
В побічної підгрупи IV групи
Г головної підгрупи IV групи

2.74 Ступінь окиснення -1 у сполуках можуть виявляти елементи
А головної підгрупи II групи
Б головної підгрупи VII групи
В головної підгрупи IV групи
Г побічної підгрупи V групи

2.75 В ряду І – Вr – Cl – F
А неметалічний характер елементів і хімічна активність відповідних простих речовин спадає
Б неметалічний характер елементів і хімічна активність відповідних простих речовин зростає
В неметалічний характер елементів посилюється, а хімічна активність відповідних простих речовин спадає
Г неметалічний характер елементів спадає, а хімічна активність відповідних простих речовин зростає

2.76 Номер періоду короткого варіанта періодичної системи відповідає кількості
А протонів в атомі елемента
Б валентних електронів
В енергетичних рівнів, на яких розміщені електрони в атомі
Г підрівнів, на яких розміщуються електрони в атомі

2.77 Укажіть найвищу валентність елемента з протонним числом 53
А V
Б VI
В VII
Г VIII

2.78 Елемент Е утворює вищий оксид складу ЕO2, а також відповідну кислоту. Укажіть формулу цієї кислоти
А H2ЕO3
Б HЕO4
В H2ЕO4
Г H3ЕO4

2.79 Укажіть місце елемента в періодичній системі за його електронною формулою: 3s23p63d34s2
А четвертий період, II група, побічна підгрупа
Б четвертий період, IV група, головна підгрупа
В четвертий період, V група, побічна підгрупа
Г третій період, IV група, головна підгрупа

2.80 Укажіть місце елемента в періодичній системі за його електронною формулою – 5s25p3
А п’ятий період, IV група, головна підгрупа
Б п’ятий період, V група, побічна підгрупа
В четвертий період, VI група, головна підгрупа
Г п’ятий період, V група, головна підгрупа

2.81 Елемент четвертого періоду утворює вищий оксид складу ЕO3. Укажіть формулу леткої сполуки з Гідрогеном елемента Е
А СН4
Б SiH4
В H2Se
Г РН3

2.82 Елемент Е третього періоду утворює кислоту складу Н3ЕO4 і розмішуєтеся в головній підгрупі. Укажіть назву елемента Е
А Бор
Б Фосфор
В Карбон
Г Алюміній

2.83 Укажіть формулу сполуки, утвореної Магнієм та Силіцієм, якщо в ній Силіцій виявляє найнижчий ступінь окиснення
A MgSi
Б Mg2Si
В MgSi2
Г Mg3Si4

2.84 Установіть відповідність між елементом та найнижчим ступенем окиснення, який він може виявляти
Елемент: | Найнижчий ступінь окиснення: |
1 Хлор | А -3 |
2 Нітроген | Б -2 |
3 Карбон | В -1 |
4 Сульфур | Г -4 |
Д -5. |
2.85 Установіть відповідність між елементом та найвищим ступенем окиснення, який він може виявляти
Елемент: | Найвищий ступінь окиснення: |
1 Хром | А +6 |
2 Станум | Б +7 |
3 Арсен | В +3 |
4 Іод | Г +4 |
Д +5 |

2.86 Установіть відповідність між назвою хімічного елемента та його характеристикою
Назва: | Характеристика: |
1 Калій | А найбільш електронегативний елемент IV групи |
2 Карбон | Б найбільш електронегативний елемент VI групи |
3 Оксиген | В найменш електронегативний елемент 4 періоду |
4 Флуор | Г найбільш електронегативний елемент |
Д найменш електронегативний елемент 3 періоду |

2.87 Установіть послідовність збільшення неметалічних властивостей елементів за електронними конфігураціями їхніх атомів
А 1s22s22p1
Б 1s22s22p5
В 1s22s22p3
Г 1s22s22p2

2.88 Установіть послідовність зростання електронегативності елементів
А Фосфор
Б Оксиген
В Флуор
Г Бор

2.89 Укажіть суму індексів у формулі вищого оксиду елемента, атом якого має 5 енергетичних рівнів, а кількість електронів на його зовнішньому рівні удвічі більша, ніж в атома Магнію
А 6
Б 5
В 4
Г З

2.90 Установіть послідовність збільшення радіусів атомів елементів за електронними формулами зовнішнього електронного шару їхніх атомів
A 3s23p5
Б 3s23p4
В 3s23p1
Г 3s23р3

2.91 Розмістіть назви елементів відповідно до послаблений їхніх відновних властивостей
А Стронцій
Б Кальцій
В Рубідій
Г Барій

2.92 Установіть послідовність посилення відновних властивостей елементів, користуючись електронними конфігураціями зовнішнього електронного шару їхніх атомів
A 6s2
Б 4s2
В 6s1
Г 5s2

2.93 Укажіть суму індексів у формулі гідрату вищого оксиду елемента, атом якого має 3 енергетичні рівні, а кількість електронів на його зовнішньому рівні удвічі менша, ніж в атома Сульфуру
А 6
Б 7
В 8
Г 9
