Тести – Урок 3
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
Тести
3.1 Укажіть тип хімічного зв’язку в речовині, формула якої NaF
А йонний
Б ковалентний неполярний
В ковалентний полярний
Г металічний
3.2 Укажіть формулу речовини з полярним ковалентним зв’язком
А КВr
Б KF
B N2
Г Н2O
3.3 Укажіть тип хімічного зв’язку в речовині, формулу якої N2H4
А ковалентний неполярний
Б
В йонний
Г водневий
3.4 Спільним у будові йонів К+ і Сl – є
А кількість протонів
Б кількість нейтронів
В кількість електронів
Г кількість протонів і нейтронів
3.5 Укажіть формулу молекули, між атомами якої існує ковалентний неполярний зв’язок
А Вr2
Б H2S
В NH3
Г NaCl
3.6 Укажіть кількість електронів, що взяли участь в утворенні зв’язків у молекулі, електронна формула якої 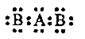
А 2
Б 4
В 8
Г 20
3.7 Укажіть формулу молекули, між атомами якої існує потрійний ковалентний зв’язок
А О2
Б Н2
В М2
Г NH3
3.8 Укажіть групу атомів, які можуть утворювати лише позитивно заряджені йони
А К, Na, Са
Б К, N, Mg
B Cl, K, Na
Г Н, Сl, Вr
3.9 Укажіть тип зв’язку в речовині, формула якої СаВr2
А ковалентний неполярний
Б йонний
В ковалентний полярний
Г водневий
3.10 Укажіть групу атомів, які можуть утворювати лише негативно заряджені йони
A Na, Ва, Вr
Б S, О, F
В S, Na, F
Г Р, І, К
3.11 Укажіть тип зв’язку для речовин, які існують лише у твердому кристалічному стані
А ковалентний полярний
Б ковалентний неполярний
В йонний
Г металічний
3.12 Укажіть, до якого елемента зміщені спільні електронні пари в молекулі ССl4
А до Карбону, оскільки його електронегативність вища, ніж у Хлору
Б до Карбону, оскільки його електронегативність вища, ніж у Хлору
В до Хлору, оскільки його електронегативність нижча, ніж у Карбону
Г до Хлору, оскільки його електронегативність вища, ніж у Карбону
3.13 Укажіть формулу речовини, для якої характерний міжмолекулярний водневий зв’язок
А СН4
Б O2
В Н2O
Г MgO
3.14 Укажіть формулу речовини, для якої характерний міжмолекулярний водневий зв’язок
А Аl2O3
Б СН3ОН
В NO
Г КОН
3.15 Укажіть пару речовин, для яких характерний міжмолекулярний водневий зв’язок
A NH3, К2O
Б РН3, Сl2
В Н2O, С2Н5ОН
Г КСl, Fe2O3
3.16 Проаналізуйте твердження і вкажіть правильні:
1) довжина подвійного зв’язку менша, ніж довжина потрійного зв’язку;
2) довжина одинарного зв’язку більша, ніж довжина подвійного зв’язку.
А правильне перше твердження
Б правильне друге твердження
В обидва твердження правильні
Г обидва твердження неправильні
3.17 Укажіть кількість електронів, які беруть участь в утворенні хімічних зв’язків у молекулі тетрахлорометану
А 8
Б 9
В 10
Г 11
3.18 Укажіть валентність і ступінь окиснення Нітрогену в солі амонію NH4HCO3
А IV; -4
Б III; -4
В III; -3
Г IV; -3
3.19 Укажіть кількість електронів, які беруть участь в утворенні хімічних зв’язків у молекулі етину
А 8
Б 9
В 10
Г 11
3.20 Укажіть кількість p-електронів, які беруть участь в утворенні хімічних зв’язків у молекулі дигідрогенсульфіду
А 2
Б 4
В 6
Г 8
3.21 Металічний зв’язок утворює елемент з електронною конфігурацією атома
А…3s23р2
Б…4s2
B…1s1
Г…3s23p6
3.22 Речовина, утворена елементами з електронними конфігураціями…2s1 і 3s23p4, має кристалічні гратки
А йонні
Б металічні,
В молекулярні
Г атомні
3.23 Укажіть кількість p-електронів, які беруть участь в утворенні ковалентних зв’язків у молекулі АlСl3
А 2
Б 3
В 4
Г 5
3.24 Установіть відповідність між хімічним складом сполуки та типом хімічного зв’язку в ній
Хімічний склад: | Тип зв’язку: |
1 Сl2 | А водневий |
2 H2S | Б йонний |
3 NH4Cl | В ковалентний неполярний |
4 NaCl | Г ковалентний полярний |
Д йонний і ковалентний |
3.25 Проаналізуйте твердження і вкажіть правильні:
1. Речовини з йонним типом кристалічної гратки відзначаються незначною твердістю.
2. Речовини з молекулярним типом кристалічної гратки відзначаються леткістю.
3. Речовини з молекулярним типом кристалічної гратки відзначаються значною твердістю.
А правильне перше твердження
Б правильне друге твердження
В всі твердження неправильні
Г правильне третє твердження
3.26 Укажіть електронні конфігурації атомів відповідних простих речовин, продукти взаємодії яких із бромом мають іонний тип кристалічних граток: 1) 2s22p5; 2) 2s1; 3) 3s23p4; 4) 3s2; 5)1s1; 6) 5s1
A 2, 4, 6
Б 2, 3, 4
В 2, 4, 5
Г 2, 5, 6
3.27 Установіть відповідність між типом кристалічних граток та назвою речовини
Тип граток: | Назва: |
1 атомні | А натрій гідроксид |
2 молекулярні | Б мідь |
3 йонні | В кисень |
4 металічні | Г силіцій(ІV) оксид |
Д парафін |
3.28 Укажіть елементи між атомами яких утворення хімічного зв’язку відповідає схемі:
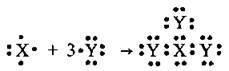
А Бром і Фосфор
Б Нітроген і Гідроген
В Фосфор і Сульфур
Г Нітроген і Оксиген
3.29 Укажіть тип зв’язку у сполуці, утвореній хімічними елементами з протонними числами 1 і 35
А ковалентний неполярний
Б йонний
В ковалентний полярний
Г водневий
3.30 Речовина, утворена елементами з електронними конфігураціями атомів…3s2 і…2s22p5, має кристалічні гратки
А атомні
Б йонні
В молекулярні
Г металічні
3.31 Речовина, утворена елементами з електронними конфігураціями атомів 1s1 і…2s22р5 має кристалічні гратки
А йонні
Б атомні
В молекулярні
Г молекулярні
3.32 Укажіть речовину, у молекулі якої є потрійний зв’язок
А аміак
Б кисень
В водень
Г азот
3.33 Укажіть схему утворення ковалентного зв’язку в молекулі простої речовини, що містить подвійний зв’язок

3.34 Укажіть тип зв’язку для речовини, утвореній хімічними елементами з порядковими номерами 17 і 19
А ковалентний неполярний
Б ковалентний полярний
В йонний
Г водневий
3.35 Хімічний зв’язок у молекулі аміаку утворюється за рахунок перекриття
А s-орбіталей атомів Гідрогену і s-орбіталей атома Нітрогену
Б s-орбіталей атома Гідрогену і трьох р-орбіталей атома Нітрогену
В трьох s-орбіталей атома Нітрогену і р-орбіталей атома Гідрогену
Г s-орбіталей трьох атомів Гідрогену і трьох p-орбіталей атома Нітрогену
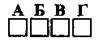
3.36 Укажіть речовину, схема утворення ковалентного зв’язку в якій 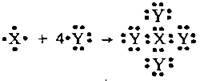
А вода
Б метан
В аміак
Г тетрахлорометан