Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами. Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп
II Семестр
Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
Урок 38
Тема уроку. Хімічні властивості карбонових кислот: електролітична дисоціація, взаємодія з металами, лугами, солями, спиртами.
Кислотність карбонових кислот, її залежність від складу й будови. Взаємний вплив карбоксильної та вуглеводневої груп
Цілі уроку: формувати знання учнів про хімічні властивості одноосновних карбонових кислот; показати взаємний вплив карбоксильної групи та вуглеводневого радикала; формувати поняття про кислотність карбонових кислот; показати
Тип уроку: вивчення нового матеріалу.
Форми роботи: навчальна лекція, евристична бесіда, лабораторний експеримент.
Лабораторний дослід 5. Дія етанової кислоти на індикатори. лабораторний
Дослід 6. Взаємодія етанової
Дослід 7. Взаємодія етанової кислоти з лугом.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Актуалізація опорних знань
1. Хімічний диктант
Зобразіть структурну формулу речовини:
2-метилпропан, пропанол, 2-бутен, етанова кислота, 2-метил-2-бутен, 2-метил-1-пропанол, етиловий спирт, мурашина кислота, 1,1-дихлоретан, метан, 3,3-диметилпентан, 2-метилпропанова кислота.
2. Повідомлення учнів про застосування оцтової кислоти
¦ На яких властивостях оцтової кислоти грунтується її застосування?
¦ чому розчин оцтової кислоти проводить електричний струм?
¦ Запишіть рівняння дисоціації оцтової кислоти.
III. Вивчення нового матеріалу
Хімічні властивості оцтової кислоти
1. Лабораторний дослід 5. Дія етанової кислоти на індикатори
Запишіть рівняння дисоціації оцтової кислоти:
CH3 – COOH 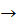 CH3 – COO – + H+
CH3 – COO – + H+
2. Взаємодія оцтової кислоти з металами Лабораторний дослід 6. Взаємодія етанової кислоти з магнієм У пробірку з розчином оцтової кислоти занурюємо шматочок магнію. Що спостерігаємо? Виділення бульбашок газу. Що це за газ? Водень.
Записуємо рівняння реакції.
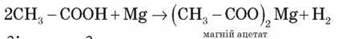
3. Взаємодія з оксидами
(Пропонуємо записати самостійно на прикладі взаємодії з кальцій оксидом.)
2CH3 – COOH + CaO  (CH3 – COO)2Ca + H2O
(CH3 – COO)2Ca + H2O
4. Взаємодія з основами
Лабораторний дослід 7. Взаємодія етанової кислоти з лугом
До розчину калій гідроксиду додаємо дві-три краплі фенолфталеїну. Потім в одержаний розчин додаємо оцтову кислоту до зникнення малинового забарвлення. чому зникло малинове забарвлення? Відбулася реакція нейтралізації.
Запишіть рівняння реакції в молекулярній та іонній формах.
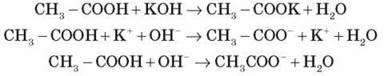
CH3 – COOH – слабкий електроліт, тому в іонних рівняннях її дисоціація не враховується.
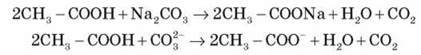
5. Взаємодія із солями
Карбонові кислоти належать до слабких кислот, однак вони сильніші від деяких неорганічних кислот, наприклад карбонатної. розглянемо на досліді. У пробірку з розчином натрій карбонату додамо оцтової кислоти. Що спостерігаємо? Запишіть рівняння хімічної реакції в молекулярній та іонній формах.
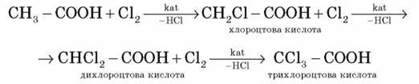
6. Взаємодія з галогенами
У процесі взаємодії з галогенами в присутності каталізатора відбувається заміщення атомів Гідрогену вуглеводневого радикала.
7. Карбонові кислоти вступають у реакції етерифікації зі спиртами:
CH3 – COOH + C2H5OH 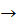 CH3 – COOC2H5 + H2O
CH3 – COOC2H5 + H2O
Утворюється естер – етиловий естер етанової кислоти (етилацетат).
Реакція утворення естеру з кислоти та спирту називається реакцією естерифікації (від лат. ether – “ефір”).
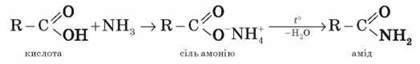
8. *Утворення амідів:
9. Повне окиснення (горіння)
CH3 – COOH + 2O2  2H2O + 2CO2
2H2O + 2CO2
IV. Первинне застосування одержаних знань
Керована практика
Завдання 1. З якими з перелічених речовин реагуватиме оцтова кислота? Запишіть рівняння можливих реакцій:
Ca, Cu, CH3OH, Na2CO3, CaO, Na2SO4, Cu(OH)2.
Завдання 2. Оцтова есенція, яку виробляє промисловість для харчових цілей, є 80%-ю оцтовою кислотою. Обчисліть масу води, яку необхідно додати до 100 г такої есенції для приготування 6%-го столового оцту.
Завдання 3. Естери – це речовини, що надають речовинам запаху та смаку. Для одержання цих речовин використовують реакцію етерифікації. Обчисліть, яку масу бутилового естеру метанової кислоти можна одержати в результаті взаємодії 20 г бутанолу і 20 г метанової кислоти.
Завдання 4. Складіть у загальному вигляді реакції:
1) утворення солей:
А) у результаті взаємодії з металами:
2RCOOH + Mg  (RCOO)2 Mg + H2
(RCOO)2 Mg + H2
Б) у реакціях з гідроксидами металів:
2RCOOH + NaOH  RCOONa + H2O
RCOONa + H2O
2) утворення естерів R’- COOR”:
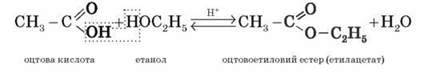
V. Підбиття підсумків уроку
1) Які властивості оцтової кислоти дозволяють зарахувати її до кислот?
2) Яка група атомів визначає фізичні й хімічні властивості карбонових кислот?
3) Які органічні речовини називаються естерами? Де їх можна використати?
Підбиваємо підсумки уроку, оцінюємо роботу учнів на уроці.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Підготуватися до практичної роботи.
Творче завдання: підібрати матеріал про естери, їх застосування в харчовій і парфумерній галузях промисловості.
