Фенол – Феноли – Оксигеновмісні органічні сполуки
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ
12. Оксигеновмісні органічні сполуки
12.2. Феноли
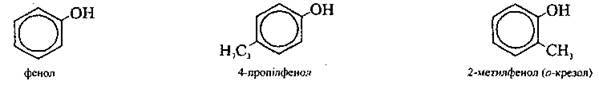
Фенолами називають похідні ароматичних вуглеводнів, у яких один або декілька атомів Гідрогену бензенового ядра заміщені на гідроксильні групи.
Одноатомні |
|
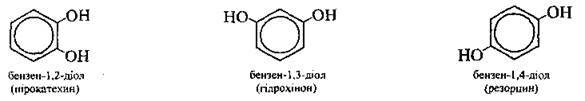
Двохатомні |
|
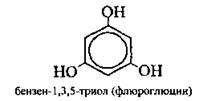
Триатомні |
|
Феноли – отруйні речовини,
12.2.1. Фенол
Фенол С6Н5ОН – безбарвна кристалічна речовина із характерним неприємним запахом.
Фенол є полярною сполукою. В його молекулі неподілена пара електронів атома Оксигену відтягується бензеновим ядром і взаємодіє з його електронною системою. Таку взаємодію називають спряженням, а спільну електронну систему – спряженою:

Унаслідок такого перерозподілу електронної густини у молекулі фенолу спостерігається:
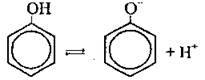
1) збільшення полярності зв’язку О-Н значно більше, ніж у молекулах одноатомних ненасичених спиртів. Електронна хмара ще більше відтягується від гідроксильного атома Гідрогену, роблячи його ще рухливішим, а отже кислотні властивості фенолу виражені значно більше, ніж у спиртів1 (але слабше, ніж у карбонатної). У водному розчині його молекула дисоціює, утворюючи фенолят-іон (лакмус змінює свій колір на червоний, а метилоранж – на рожевий):
2) збільшення електронної густини в орто – і пара-положеннях (положення 2, 4 і 6) бензенового ядра, де на атомах Карбону виникають часткові негативні заряди, а на відповідних атомах Гідрогену – позитивні, що робить їх рухливішими і вони легко вступають у реакції заміщення. Фенол значно активніший за бензен.
Добування фенолу
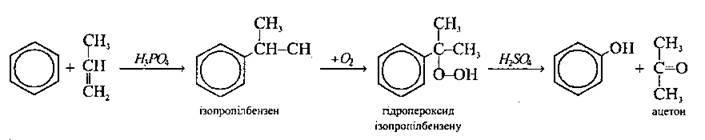
1. Кумольний метод – окиснення ізопропілбензену (кумолу):
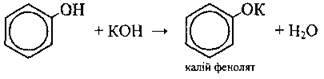
2. Виділення з кам’яновугільної смоли. Для виділення фенолів з кам’яновугільної смоли її обробляють лугом. Феноли реагують з лугом і переходять у розчин у вигляді добре розчинного феноляту, що легко відділяється від нерозчинної у воді кам’яновугільної смоли:
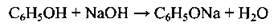
Добутий розчин феноляту обробляють вуглекислим газом або розбавленою мінеральною кислотою, які розкладають фенолят з утворенням фенолу:
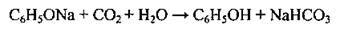
3. Гідроліз арилгалогенідів:
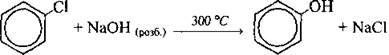
Хімічні властивості фенолу
Реакції за участі О-Н зв’язку | |||
З водними розчинами лугів |
| ||
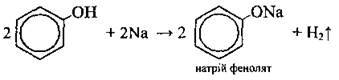
З лужними металами (відбувається бурхливо) |
| ||
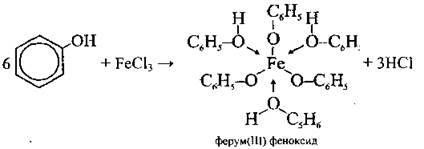
З ферум(ІІІ) хлоридом |
| Якісна реакція на фенол: Утворюється комплексна сіль темно-фіолетового кольору | |
Реакції за участі бензенового кільця | |||
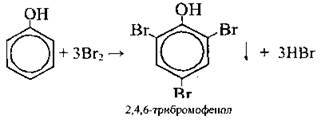
Із бромною водою |
| Якісна реакція на фенол: Утворюється білий осад | |
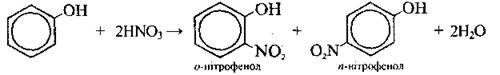
Нітрування | 20% HNО3 |
| Утворюється суміш Нітрофенолів |
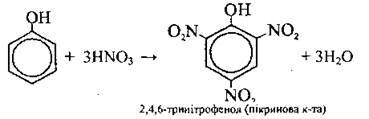
HNО3 (конц.) |
|
Застосування фенолу
Фенол використовують як антисептик, консервант у вакцинах, протраву для деревини, а також у виробництві:
1) бісфенолу А (сировини для виробництва пластмас, полікарбону та епоксидних смол);
2) фенолформальдегідних смол (текстоліт, склотекстоліт, гетінакс, карболіт)
3) циклогексанолу (який іде на виробництво нейлону, капрону);
4) вибухових речовин (2,4,6-тринітрофенолу);
5) поверхнево-активних речовин;
6) ліків (ацетилсаліцилової кислоти);
7) антисептиків (бісмут трибромофеноляту, ксероформу);
8) пестицидів;
9) крезолів (з яких виробляють барвники, гуми, антисептики, інсектициди, гербіциди, фунгіциди тощо).
_________________________________________________________________
1 Ось чому традиційна назва фенолу – карболова кислота.