КОНТРОЛЬНА РОБОТА № 1 З ТЕМИ “НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ”
ТЕМА 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ
УРОК 7. КОНТРОЛЬНА РОБОТА № 1 З ТЕМИ “НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ”
Цілі: перевірити й закріпити знання про прості речовини неметали, леткі сполуки неметалів з Гідрогеном, їх склад, властивості, добування; формувати вміння складати хімічні формули й рівняння реакцій.
Обладнання: роздавальний матеріал.
Тип уроку: контроль знань.
Форми роботи: письмова тестова перевірка.
ХІД УРОКУ
I. Організація класу
II. Інструктаж щодо виконання завдань
III. Самостійне виконання
I варіант
1. До неметалів належить:
А) Li;
Б) Be;
В) Se;
Г) Mn.
2. Найвищий ступінь окиснення Фосфору:
А) +5;
Б) +3;
В) -3;
Г) +6.
3. Хлор утворює летку сполуку з Гідрогеном типу:
A) EH3;
Б) EH4;
В) НЕ;
Г) H2E.
4. Озоновий шар знаходиться від Землі на відстані:
А) 10-15 км;
Б) 15-20 км;
В) 20-25 км;
Г) 40 км.
5. Нашатирний спирт – це:
А) розчин HCl;
Б) розчин NH3;
В) розчин HNO3;
Г) розчин H2S.
6. Найнижчий ступінь окиснення Карбону:
А) 0;
Б) -2;
В) -3;
Г) -4.
7. У водному розчині гідроген хлориду лакмус набуває забарвлення:
А)
Б) червоного;
В) фіолетового;
Г) малинового.
8. Кількість електронів на зовнішньому енергетичному рівні в атома Нітрогену дорівнює:
A) 3;
Б) 4;
В) 5;
Г) 6.
9. Сульфур може проявляти валентності:
A) І;
Б) ІІ;
В) ІІІ;
Г) VІ.
10. Із графіту виготовляють:
A) синтетичні алмази;
Б) свердла;
В) електроди;
Г) шліфувальні диски.
11. Які іони утворяться під час дисоціації (NH4 )2 SO4 ?
A) N3-;
Б) NH4+;
В) H+;
Г) SO42-.
12. Внаслідок взаємодії яких сполук утворюється NH4NO3?
A) H2O;
Б) HNO3;
В) NH3;
Г) N2O.
13. Гідроген хлорид можна одержати внаслідок взаємодії таких речовин:
A) NaCl(тв.);
Б) розчин KCl;
В) H2SO4(конц.);
Г) HNO3.
14. Виберіть ознаки, що характеризують властивості речовин.
Речовина Фізичні властивості
1) HCl а) Важчий за повітря
2) NH3 б) Легший за повітря
В) Безбарвний
Г) Жовто-зелений
15. Складіть рівняння реакцій:
А) C + Н2 
Б) H2S + O2 
В) N2 + Na 
16. Складіть рівняння реакції та розставте коефіцієнти методом електронного балансу: 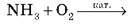
17. Складіть рівняння можливої реакції, запишіть для неї повне і скорочене іонне рівняння:
А) K2S + HNO3 
Б) AgCl + HPO3 
18. Обчисліть об’єм амоніаку, що утвориться внаслідок взаємодії азоту масою 4,2 г з воднем.
19. Запишіть рівняння реакцій, що відповідають перетворенням, і дайте назви сполукам:
NH3  NH3 – H2O
NH3 – H2O  NH4NO3
NH4NO3  NH3
NH3  N2.
N2.
20. Обчисліть об’єм амоніаку, що виділиться під час нагрівання розчину, утвореного зливанням розчину амоній сульфату масою 45 г з масовою часткою солі 10 % і розчину натрій гідроксиду.
II варіант
1. До неметалів належить:
А) Rb;
Б) As;
В) Al;
Г) Cr.
2. Найвищий ступінь окиснення Нітрогену:
A) +6;
Б) +5;
В) +4;
Г) +3.
3. Сульфур утворює летку сполуку з Гідрогеном типу:
A) EH3;
Б) EH4;
В) НЕ;
Г) H2E.
4. Роль озонового шару:
А) затримка ультрафіолетової радіації Сонця;
Б) забруднення атмосфери;
В) підтримка дихання живих організмів;
Г) участь у процесі фотосинтезу.
5. Іон амонію – це:
A) H3O+;
Б) NO3-;
В) NH4+;
Г) NO2-.
6. Найнижчий ступінь окиснення Фосфору:
A) 0;
Б) -2;
В) -3;
Г) -4.
7. У водному розчині амоніаку лакмус набуває забарвлення:
A) синього;
Б) червоного;
В) фіолетового;
Г) малинового.
8. Кількість електронів на зовнішньому енергетичному рівні в атома Карбону дорівнює:
A) 3;
Б) 4;
В) 5;
Г) 6.
9. Фосфор може проявляти валентності:
A) ІІ;
Б) ІІІ;
В) ІV;
Г) V.
10. З алмазу виготовляють:
A) синтетичні алмази;
Б) свердла;
В) електроди;
Г) шліфувальні диски.
11. Які іони утворяться під час дисоціації NH4NO3?
A) N3-;
Б) NH4+;
В) H+;
Г) NO3-.
12. Внаслідок взаємодії яких сполук утворюється (NH4 )2 SO4 ?
A) H2O;
Б) H2SO4;
В) NH3;
Г) N2.
13. Амоніак можна одержати внаслідок взаємодії таких речовин:
A) NH4Cl;
Б) Ca(OH)2;
В) H2O;
Г) HCl.
14. Виберіть ознаки, що характеризують властивості речовин.
Речовина Фізичні властивості
1) NH3 а) Без запаху
2) HCl б) З різким запахом
В) Добре розчинний у воді
Г) Погано розчинний у воді
15. Складіть рівняння реакцій:
А) NH3 + H3PO4 
Б) H2 + Cl2 
В) Mg + P 
16. Складіть рівняння реакції та розставте коефіцієнти методом електронного балансу: NH3 + O2 
17. Складіть рівняння можливої реакції, запишіть для неї повне і скорочене іонне рівняння:
А) NH4Cl + NaOH 
Б) KCl + HCl 
18. Обчисліть масу солі, яку можна одержати внаслідок дії нітратною кислотою на амоніак об’ємом 11,2 л?
19. Запишіть рівняння реакцій, що відповідають перетворенням, і дайте назви сполукам:
N2  NH3
NH3  (NH4)2 SO4
(NH4)2 SO4  NH3
NH3  NO.
NO.
20. Обчисліть об’єм повітря з об’ємною часткою кисню 21 %, що витратиться на випалювання ферум(ІІ) сульфату масою 30,16 г.
III варіант
1. До неметалів належить:
А) I;
Б) Cd;
В) Sn;
Г) Co.
2. Найвищий ступінь окиснення Сульфуру:
А) +4;
Б) +7;
В) +2;
Г) +6.
3. Карбон утворює летку сполуку з Гідрогеном типу:
А) EH3;
Б) EH4;
В) НЕ;
Г) H2E.
4. Явище існування хімічного елемента у вигляді кількох простих речовин – це:
А) адсорбція;
Б) дисоціація;
В) асоціація;
Г) алотропія.
5. Розчин амоніаку у воді проявляє властивості:
А) кислотні;
Б) основні;
В) амфотерні.
6. Найнижчий ступінь окиснення Нітрогену:
А) 0;
Б) -2;
В) -3;
Г) -4.
7. У водному розчині гідроген хлориду метиловий оранжевий набуває забарвлення:
А) жовтого;
Б) рожевого;
В) оранжевого;
Г) фіолетового.
8. Кількість електронів на зовнішньому енергетичному рівні в атома Оксигену дорівнює:
А) 3;
Б) 4;
В) 5;
Г) 6.
9. До алотропних видозмін Карбону належать:
А) озон;
Б) графіт;
В) алмаз;
Г) кисень.
10. Азот використовується для:
А) добування амоніаку;
Б) виробництва гуми;
В) виробництва сірників;
Г) наповнення електроламп.
11. Які іони утворяться під час дисоціації (NH4 )PO4 ?
А) PO43-;
Б) H+;
В) N3-;
Г) NH4+.
12. Внаслідок розкладу під час нагрівання NH4NO3 утворюються сполуки:
А) H2O;
Б) N2O;
В) HNO3;
Г) NH3.
13. Гідроген хлорид можна одержати внаслідок взаємодії таких речовин:
А) КСl(тв.);
Б) H3PO4;
В) розчин CaCl2;
Г) H2SO4 (конц.).
14. Виберіть ознаки, що характеризують властивості речовин.
Речовина Фізичні властивості
1. HCl а) Бурий
2. NH3 б) Безбарвний
В) Погано розчинний у воді
Г) Добре розчинний у воді
15. Складіть рівняння реакцій:
А) Li + S 
Б) NH3 + HCl 
В) N2 + Н2 
16. Складіть рівняння реакції і розставте коефіцієнти методом електронного балансу: CH4 + O2 
17. Складіть рівняння можливої реакції, запишіть для неї повне і скорочене іонне рівняння:
А) N2 + HNO3 
Б) CaCl2 + AgNO3 
18. Обчисліть об’єм амоніаку, який виділиться внаслідок взаємодії амоній хлориду масою 5,35 г з натрій гідроксидом.
19. Запишіть рівняння реакцій, що відповідають перетворенням, і дайте назви сполукам:
Cl2  HCl
HCl  NH4Cl
NH4Cl  CaCl2
CaCl2  AgCl.
AgCl.
20. Обчисліть об’єм гідроген сульфіду, який виділиться внаслідок дії розчину хлоридної кислоти об’ємом 100 мл (густина 1,098 г/мл) з масовою часткою гідроген хлориду 20 °% на натрій сульфід.
IV варіант
1. До неметалів належать:
А) V;
Б) Те;
В) Ni;
Г) K.
2. Найвищий ступінь окиснення Карбону:
A) +6;
Б) +4;
В) +2;
Г) 0.
3. Нітроген утворює летку сполуку з Гідрогеном типу:
A) EH3;
Б) EH4;
В) НЕ;
Г) H2E.
4. Здатність притягувати до своєї поверхні молекули речовин з навколишнього середовища – це:
A) адсорбція;
Б) дисоціація;
В) асоціація;
Г) алотропія.
5. Розчин гідроген хлориду у воді проявляє властивості:
A) кислотні;
Б) основні;
В) амфотерні.
6. Найнижчий ступінь окиснення Сульфуру:
A) 0;
Б) -2;
В) -3;
Г) -4.
7. У водному розчині амоніаку метиловий оранжевий набуває забарвлення:
A) жовтого;
Б) рожевого;
В) оранжевого;
Г) фіолетового.
8. Кількість електронів на зовнішньому енергетичному рівні в атома Сульфуру дорівнює:
A) 3;
Б) 4;
В) 5;
Г) 6.
9. До алотропних видозмін Оксигену належать:
A) озон;
Б) графіт;
В) карбін;
Г) кисень.
10. Сірка використовується для:
A) добування амоніаку;
Б) виробництва гуми;
В) виробництва сірників;
Г) наповнення електроламп.
11. Які іони утворяться під час дисоціації NH4Cl?
A) NH4+;
Б) H+;
В) N3-;
Г) Cl-.
12. Внаслідок розкладу під час нагрівання (NH4)2СО3 утворюються сполуки:
A) CO2;
Б) NH3;
В) N2O;
Г) H2.
13. Амоніак можна одержати внаслідок взаємодії таких речовин:
A) H2O;
Б) NaOH;
В) (NH4)2SO4;
Г) HCl.
14. Виберіть ознаки, що характеризують властивості речовин.
Речовина Фізичні властивості
1. NH3 а) Легший за повітря
2. HCl б) Важчий за повітря
В) З різким запахом
Г) Без запаху
15. Складіть рівняння реакцій:
А) NH3 + H2SO4 
Б) Al + S 
В) N2 + О2 
16. Складіть рівняння реакції та розставте коефіцієнти методом електронного балансу: ZnS + O2 
17. Складіть рівняння можливої реакції, запишіть для неї повне і скорочене іонне рівняння:
А) LiCl + HNO3 
Б) (NH )2SO4 + KOH 
18. Обчисліть об’єм кисню, який витратиться на окиснення азоту масою 5,6 г.
19. Запишіть рівняння реакцій, що відповідають перетворенням, і дайте назви сполукам:
N2  NH3
NH3  NH4Cl
NH4Cl  BaCl2
BaCl2  AgCl.
AgCl.
20. Обчисліть масу осаду, що утвориться внаслідок взаємодії розчину натрій хлориду з розчином аргентум нітрату масою 20 г з масовою часткою солі 2 %.
IV. Домашнє завдання